Citometría de flujo
La CMF es una técnica analítica multiparamétrica que permite obtener información sobre poblaciones celulares a partir del estudio individual de un número considerable, estadísticamente adecuado, de células (en un rango de entre 500 y 10000 células). En concreto permite el recuento y clasificación según las características morfológicas y/o la presencia de biomarcadores.
Se fundamenta en hacer pasar un grupo de células (vivas o fijadas) o partículas, suspendidas en una solución isotónica, por un capilar (tubo muy fino) transparente de manera tal de que quedan alineadas en una fila india, es decir, una detrás de otra.
Esta corriente de células se hace pasar frente a un haz luminoso, cuya dispersión y fluorescencia será recogida por un sistema de detectores para ser analizadas. Los datos en bruto que típicamente se obtienen de forma simultánea por cada célula son:
1. Dispersión frontal de la luz a 2º (FSC o forward scatter), valor proporcional al tamaño celular.
2. Dispersión de la luz ortogonal (SSC o side scatter), proporcional a la cantidad de estructuras granulares o complejidad de la célula.
3. Intensidades de fluorescencia (SFL o side fluorescence) a diferentes longitudes de onda.
El procesamiento de estos datos permite medir diferentes parámetros de las células como el tamaño celular, granularidad del citoplasma, viabilidad, fase del ciclo celular, contenido de adn, fenotipo según marcadores de superficie, etc, esta información permite identificar poblaciones de células:
- Aneuploides: Célula con cromosomas adicionales o faltantes.
- Diploides: Estado de una célula en el que su núcleo posee dos juegos completos de cromosoma.
- Euploides o poliploidia: la célula tiene uno o más juegos completos de cromosomas.
- Aneuploides: Célula con cromosomas adicionales o faltantes.
- Diploides: Estado de una célula en el que su núcleo posee dos juegos completos de cromosoma.
- Euploides o poliploidia: la célula tiene uno o más juegos completos de cromosomas.
Si necesitas refrescar tus conocimientos, en entradas anteriores hablé sobre el fenómeno de dispersión de la luz y de la fluorescencia.

Citometría de flujo en la evaluación de la proliferación celular
Normalmente cerca del 90% de las células de un determinado tejido están en fase G0 o G1 del ciclo celular, es decir, no se están dividiendo y su carga cromosómica está formada por el número de pares propios de la especie. El resto de las células está sintetizando ADN (S), ya ha duplicado el adn y se preparan para la división (G2) o están en mitosis (M).
El parámetro que cuantifica la actividad proliferativa es el porcentaje de células en fase S.
Citómetro de flujo
Es un equipo especializado y altamente sensible capaz de analizar varios miles de partículas por segundo. Está compuesto por 3 sistemas: fluídico, óptico y electrónico.
 |
| Citometro de flujo y PC-. |
Sistema fluídico: Consigue el alineamiento de las partículas o células.
Sistema óptico: Consigue enfocar el láser en un haz de diámetro reducido para asi incidir en el menor número de células o partículas posible simultáneamente.
Sistema Electrónico: Se encarga de cuantificar la fluorescencia y luz dispersada.
Se utilizan 2 tipos de detectores, ambos basados en el efecto fotoeléctrico, como son:
- Fotodiodos de silicio: Menos eficientes, se usan para FSC.
- Tubos fotomultiplicadores. Más eficientes, se usan para fluorescencia y SSC.
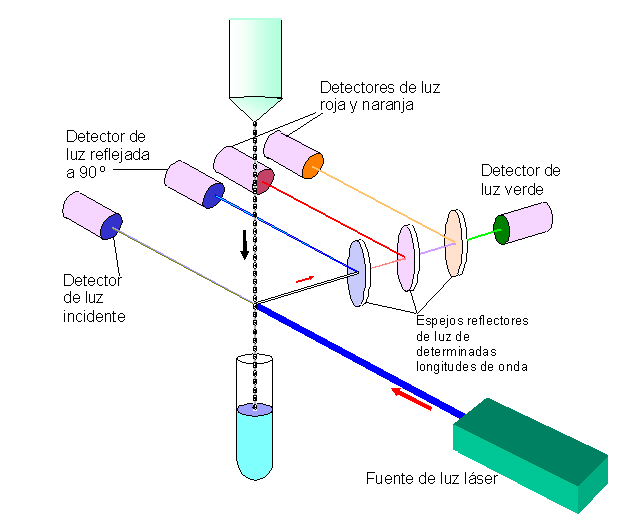 |
| Esquema del citómetro. |
Preparación de la muestra para de la Citometría de flujo.
El primer paso para la preparación de la muestra consiste en la obtención o producción de las células en suspensión, algo que puede obtenerse fácilmente de la sangre (leucemias) y otros fluidos pero no de tumores sólidos, y el segundo en el mantenimiento de las funciones y propiedades celulares.
Para la obtención de poblaciones representativas, con un rendimiento suficiente y preservando la superficie celular, se utilizan técnicas de disociación mecánica, enzimática o mixta.
Siempre se debe comprobar la preparación mediante microscopía, incluidos los controles y asegurarse que estamos trabajando con un método reproducible y sin artefactos.
Para la obtención de poblaciones representativas, con un rendimiento suficiente y preservando la superficie celular, se utilizan técnicas de disociación mecánica, enzimática o mixta.
Siempre se debe comprobar la preparación mediante microscopía, incluidos los controles y asegurarse que estamos trabajando con un método reproducible y sin artefactos.
Luego se deben introducir a la muestra anticuerpos monoclonales marcados con fluorocromos, lo que permite evaluar qué células poseen los antígenos complementarios a los anticuerpos monoclonales usados. La principal ventaja que ofrecen los anticuerpos monoclonales es que permiten fijar una sola y única molécula diana en la membrana de las células que se están analizando
Ventajas y limitaciones de la Citometría de flujo.
Ventajas:
- Analizar un gran número de células lo que otorga validez estadística a los resultados.
- Rapidez.
- Mayor Sensibilidad
- Posibilidad de empleo de múltiples marcajes frente a uno solo en citoquímica y microscopia de fluorescencia.
- Permite almacenar la información en una computadora de manera directa.
Desventajas:
- No se ven las células.
- Mezcla con células no neoplásicas o diferentes a las objetivos.
- Costo del equipo.
- Se pierde información sobre la arquitectura del tejido debido a la necesidad de crear la suspensión de células.
Aplicaciones de la Citometría de flujo.
La citometría de flujo tiene aplicaciones en numerosos campos, incluyendo la biología molecular, inmunología, biología vegetal y marina. En el campo de la medicina en estudios de trasplantes, hematología (tipificación de leucemias), inmunología tumoral, y quimioterapia, diagnóstico prenatal, genética y selección de esperma para una preselección de sexo. También se utiliza en biología marina e ingeniería de proteínas.
Su principal aplicación oncológica es la evaluación y seguimiento de leucemias agudas, leucemias linfoblástica crónicas y otros síndromes linfoproliferativos con infiltración medular o expresión en sangre periférica. Tiene una sensibilidad de 10-4 a 10-5, es decir, detecta una célula tumoral de entre 10.000 y 100.000 células normales (Tomás et al., 2004).
Citometria from guest4bf4ee
Fuentes:
Información obtenida en el aula a través de la profesora de la cátedra de Citología, Marian Nadales. Laboratorio Clínico Marian Nadales T.



Comentarios
Publicar un comentario