Enzimas, catálisis, cinética y factores que afectan la actividad enzimática.
La concentración de sustrato específica a la cual una enzima determinada alcanza la mitad de su velocidad máxima, corresponde a la constante de Michaelis (Km) que es característica para cada enzima sobre un sustrato determinado, en condiciones definidas de pH y temperatura.
El valor de KM da idea de la afinidad del enzima por el sustrato: A menor Km, mayor afinidad del enzima por el sustrato, y a mayor Km, menor afinidad.
Fuentes:
- Principios de Bioquímica. Lehninger, A. 5ta. Edición.
- Bioquímica Mathews, Christopher. 4ta Edición.
- Bioquímica del Harper-Murray R, Mayes P, Granner D, Rodswel V. 29 Edición.
- Wikipedia:
- Curso de biomoléculas, Tema 11: Enzimas.
- Guia de trabajos practicos "Bioquimica general". Profesores del Departamento de Bioquímica de la escuela de ciencias biomédicas y tecnológicas de la Universidad de Carabobo. Marzo 2013.
Enzimas
Son polímeros biológicos que catalizan las reacciones químicas que hacen posible la vida tal y como la conocemos. Proporcionan un ambiente específico dentro del cual una reacción determinada puede ocurrir a mayor velocidad.
Son consideradas como las unidades funcionales del metabolismo celular y casi en su totalidad son de naturaleza proteica, con excepciones notables como las ribozimas. Además de ser muy eficientes, pues son capaces de aumentar las velocidades de reacción en un factor de entre 10^5 y 10^17 las enzimas también son altamente específicas tanto para el tipo de reacción catalizada como para el o los sustratos admitidos.
Catálisis enzimática
En términos generales un catalizador es una sustancia que aumenta la rapidez de una reacción química sin verse alterada si misma en el proceso, de hecho, la mayoría de las reacciones en el organismo deben ser catalizadas para que se den a velocidades que puedan mantener la vida.
La catálisis permite a la célula canalizar las sustancias hacia rutas que sean útiles, evitando se desvíen a reacciones colaterales no productivas.
Cinética enzimática
Es el campo de la bioquímica que se encarga de la medición cuantitativa de los índices de reacciones catalizadas por enzimas así como de los factores que afectan dichos índices.
El estudio de la cinética enzimática, parte de la fijación del sustrato (S) en la enzima (E), lo cual, da lugar a la formación del complejo enzima-sustrato (E-S), que posteriormente se desdobla en enzima (E) y producto(s) libre(s) (P):
La velocidad de una reacción enzimática se mide al determinar la concentración de sustrato que desaparece o la concentración de producto que se genera por unidad de tiempo a un temperatura y pH constantes.
Factores físicos que afectan la actividad enzimática
Concentración de la enzima [E]
La velocidad inicial (Vo) de una reacción enzimática siempre es directamente proporcional (relación lineal) a la concentración de la enzima mientras exista una cantidad suficiente de sustrato de manera tal que no limite la formación del complejo E-S. Si se continúa añadiendo enzima, eventualmente se alcanzará un punto donde se pierde la relación lineal por un descenso de la velocidad como resultado de la presencia de enzima libre no asociada a sustrato.
Concentración del sustrato [S]
Con un aumento progresivo de la concentración de sustrato, la velocidad inicial (Vo) de la reacción se incrementa hasta alcanzar un valor límite llamado velocidad (Vmax). Esto ocurre debido a la saturación de la enzima, es decir, todas las moléculas de la enzima están enlazadas con moléculas de sustrato. La gráfica se conoce como hipérbola rectangular.
 |
| Extraído de Bioquímica de Harper. |
La concentración de sustrato específica a la cual una enzima determinada alcanza la mitad de su velocidad máxima, corresponde a la constante de Michaelis (Km) que es característica para cada enzima sobre un sustrato determinado, en condiciones definidas de pH y temperatura.
El valor de KM da idea de la afinidad del enzima por el sustrato: A menor Km, mayor afinidad del enzima por el sustrato, y a mayor Km, menor afinidad.
Temperatura (T)
Aumentar la temperatura incrementa la energía cinética de las moléculas, incluida la misma enzima. Si se excede el limite energetico de los enlaces no covalentes que mantienen la estructura tridimensional de la enzima, esta comienza a desnaturalizarse y en consecuencia se evidencia un descenso pronunciado de la actividad catalítica. La mayoría de las enzimas comienzan a desnaturalizarse hacia los 40-50°C.
La temperatura óptima es aquella donde la enzima alcanza el máximo valor de velocidad y suele corresponder a un valor igual o superior al de la célula donde se encuentran la enzima pues la mayoría de las enzimas tienen una temperatura óptima similar al medio fisiológico en el que funcionan.
Por debajo de la temperatura óptima la velocidad de reacción aumenta como consecuencia del aumento de la temperatura y por tanto de la energía cinética, en contraparte, a temperaturas superiores a la óptima la velocidad de reacción decrece debido a la desnaturalización por calor de la enzima.
 |
| Temperatura óptima y desnaturalización. |
pH
Casi todas las enzimas intracelulares muestran un pH óptimo a valores de pH de entre 5 y 9. Valores extremos por encima o por debajo estos traen como consecuencia la desnaturalización irreversible de la enzima. De igual manera el pH también puede modificar el grado de ionización del sustrato, disminuyendo también así la velocidad de la reacción.
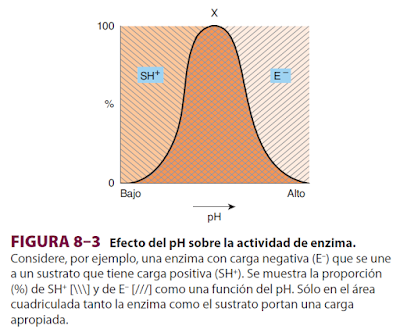 |
| Extraído de Bioquímica de Harper. |
Fuentes:
- Principios de Bioquímica. Lehninger, A. 5ta. Edición.
- Bioquímica Mathews, Christopher. 4ta Edición.
- Bioquímica del Harper-Murray R, Mayes P, Granner D, Rodswel V. 29 Edición.
- Wikipedia:
- Curso de biomoléculas, Tema 11: Enzimas.
- Guia de trabajos practicos "Bioquimica general". Profesores del Departamento de Bioquímica de la escuela de ciencias biomédicas y tecnológicas de la Universidad de Carabobo. Marzo 2013.




Comentarios
Publicar un comentario